终结60年医学难题?全球首个RSV疫苗却难以保护最核心易感人群
近日,美国食品药品监督管理局(FDA)批准葛兰素史克(GSK)的呼吸道合胞病毒(RSV)疫苗Arexvy。
这是经过60年的研究,世界第一个获批上市的呼吸道合胞病毒疫苗。但需注意的是,该疫苗的接种人群为60岁及以上年龄段人群,而非RSV的最核心易感人群,即5岁以下儿童。
呼吸道合胞病毒(Respiratory Syncytial Virus,简称RSV)是一种感染呼吸道的病毒,常见于婴幼儿和老年人,尤其是出生不足6个月、免疫力低下或有慢性疾病的患者。RSV可引起儿童呼吸道疾病、肺炎和支气管炎等重症,是全球范围内最常见的儿童呼吸道感染病原体之一。
由于其高度易感,RSV也被称为“每个人一生中都会感染的病毒”。该病毒易于传播,主要通过直接接触带病毒的人或物体进行传播,尤其是婴幼儿和幼儿园小朋友之间的传播风险较高。RSV临床表现较为复杂,包括发热、咳嗽、流鼻涕、喘息声等症状,严重的情况下可能引发呼吸急促、呼吸暂停和发绀等危及生命的症状。
| RSV疫苗的坎坷研发之路
呼吸道合胞病毒(RSV)于1956年被发现,很快被认为是儿童疾病最常见的原因之一。20世纪60年代,一种实验性疫苗在婴儿身上进行了测试。但注射疫苗非但没有保护婴儿,反而加剧了疾病,
最初尝试研发的RSV疫苗产品是减活或灭活疫苗,这在当时也是一项成熟的技术。然而20世纪60年代中先后开展的多项研究中,全球第一个进入临床研究、辉瑞的RSV福尔马林灭活疫苗并没有起到预想中的作用,反而出现了疾病增强作用(ERD),导致接种人员在感染RSV后病情加重,导致更多人住院,两人死亡。
由于出现了受试儿童死亡事件,FDA紧急暂停了所有RSV疫苗的临床研究,自此,RSV疫苗的研发进入了相当长的沉默期。直至ERD出现的原因被破译--疫苗激活了Th2-CD4+ T细胞,进一步导致了相关细胞因子介导的肺炎。这给疫苗研发注入了强心针,但后续的研发过程同样不够顺利。
先是Novavax公司研制的 RSV F蛋白重组纳米颗粒疫苗(ResVax)在针对老年人的3期临床试验中未达到主次要重点,随后针对孕妇的临床试验同样失败;GSK的一款候选疫苗GSK3003891A在2期临床开展后不久便宣布终止。
为什么RSV疫苗难以开发呢? 这与它的结构有关,RSV是一种单链RNA病毒,包括8种结构蛋白(F、G、M2-1、M2-2、SH、N、P、L)和 3 种非结构蛋白(NS1、NS2、NS3)。其中融合蛋白(fusion protein , F)和粘附蛋白(attachment protein, G)是病毒入侵人体的关键,二者都可以成为病毒研发的理想靶点,而由于G蛋白变异较多相对不稳定,F蛋白便成为了重要靶点。
但是,F蛋白有两个构象:活性构象(与宿主细胞融合前的pre-F);非活性构象(与宿主细胞融合后的post-F)。pre-F有六个主要的抗原位点(Ø, I, II, III, IV, 和 V),post-F有四个(I, II, III, 和 IV)。前者抗原性强,但相对不稳定,后者较为稳定,但抗原性不强[5]。这两种构象都已作为候选疫苗进入临床评估程序。
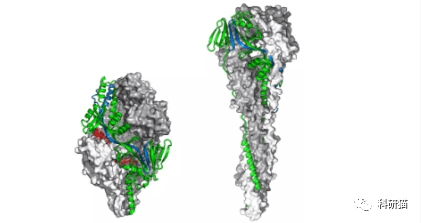
F蛋白的两种不同构象
为了解决pre-F结构不稳定的问题,科学家们研发了对该蛋白结构进行改造的技术,在增加稳定性的同时也保留了F蛋白pre-F构象的中和敏感性表位。
|葛兰素史克公司的Arexvy疫苗
此次葛兰素史克公司的Arexvy呼吸道合胞病毒疫苗,就是用包含重组亚单位预融合的RSV F糖蛋白抗原(RSVPreF3),与专有的AS01E佐剂相结合。需要注意的是,该款RSV疫苗的本次批准的适用人群为60岁及以上老年人群,不过RSV的最核心易感人群5岁以下的儿童。
RSV感染是引起全球幼儿下呼吸道感染的首要诱因,也是5岁以下儿童的第二大致死因素。2019年全球5岁以下儿童中约有3300万RSV-ALRTI(RSV 病毒感染伴随急性下呼吸道感染症状)病例,并导致其中约360万儿童住院以及10万儿童死亡(数据来源:柳叶刀)。
然而令人遗憾的是,现在无论是GSK获批上市的Arexvy,还是辉瑞完成III期临床的二价RSV疫苗,均是针对60岁以上老人,在儿童RSV疫苗方面,至今仍未获得实质性突破。
葛兰素史克公司在Arexvy疫苗中采用的佐剂AS01在同为老人疫苗的带状疱疹疫苗产品已有应用,真实世界的反馈其在增强免疫刺激的同时,不良反应发生率也非常高,不大可能用于儿童产品。
在研的多款针对儿童获得免疫力的RSV疫苗,将研究思路放在给孕妇接种RSV疫苗,让母亲产生抗体并通过胎盘传递给胎儿。但至今没能听到好消息,多项临床已终止。对于儿童,预防和控制RSV的方法主要还是加强个人卫生习惯、定期通风、保持良好的生活环境和加强免疫力等。
尽管如此,葛兰素史克公司的Arexvy疫苗也是历史性的突破,预计将打开了100亿美元级别的市场,有机会成为新一代的‘苗王’。
